co je iontová vazba?
chemické vazby se tvoří, když je celková energie vázaných atomů nižší než celková energie jednotlivých atomů.Forma vazby je určena elektronovým uspořádáním, které minimalizuje energii.
v některých případech jsou elektrony sdíleny mezi atomy – to se nazývá kovalentní vazba.
v jiných případech dochází k úplnému přenosu jednoho nebo více elektronů z jednoho atomu na druhý.Atom, který ztrácí elektrony, se stává kladně nabitým iontem.Atom, který přijímá elektrony, se stává záporně nabitým iontem.
To vede k iontové vazby – vzájemné elektrostatické přitažlivosti kladných a záporných nábojů.Ve své nejčistší podobě, iontové vazby není směrové. To může být považováno za jednoduchou Coulombickou přitažlivost mezi bodovými náboji.To se liší od kovalentní vazby, ve které sdílení elektronů vede ke směrovým vazbám.
Přenos Elektronů
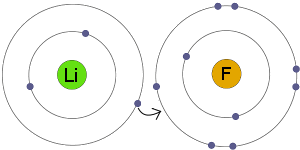
Li přenáší elektron na F. výsledkem je, že oba výsledné ionty se stávají elektricky nabité a mít kompletní, stabilní elektronové orbitaly.
Elektrostatická Přitažlivost
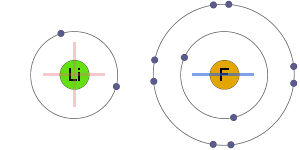
pozitivní a negativní ionty jsou elektrostaticky přitahovány k jedné další, což vede k iontovou vazbu.
coulombic síly nemá žádný preferovaný směr, s tím výsledkem, že iontové sloučeniny mají tendenci existovat jako obří krystalové mřížky struktury iontů baleny společně.
Vzorek Fluorid Lithný je Krystalové Mřížky

Elektronegativity a Iontové vazby
Dva prvky, bude mít tendenci se spojit iontově když se velmi liší v elektronegativitě.
Periodická tabulka elektronegativity
čím světlejší je odstín zelené, tím vyšší je elektronegativita. Šedá znamená, že není známa žádná hodnota. (Klikněte na obrázek pro větší zobrazení.)

Kovalentní vazby Znak
Absolutně čisté iontově vázané sloučeniny nemusí skutečně existovat, protože je kladně nabitý ion se kumuluje negativní ion je elektronový mrak.To je zvláště patrné při jednání s malými, vysoce nabitými kovovými ionty, jako je Al3+, i když polarizační účinek je do jisté míry přítomen ve všech iontových sloučeninách.Polarizace je účinně směrový efekt sdílení elektronů, proto zavádí malé množství kovalence v iontových sloučeninách.
podíl iontového / kovalentního chování ve vazbě lze velmi zhruba posoudit pomocí Paulingovy stupnice elektronegativity.Linus Pauling odhadl, že rozdíl elektronegativity 1, 7 mezi prvky vede k vazbě, která je 50% iontová.
Hodnoty nižší než 1 odpovídají kovalentní vazby dominující a hodnoty nad 2 iontové vazby dominující.
Electronegativity of Selected Elements (Pauling Scale)
| Element | Electronegativity |
|---|---|
| hydrogen | 2.20 |
| lithium | 0.98 |
| sodium | 0.93 |
| aluminum | 1.61 |
| carbon | 2.55 |
| oxygen | 3.44 |
| chlorine | 3.16 |
| iodine | 2.66 |
C-H vazba s rozdílem 0,35 bude kovalentní, zatímco NaCl lepení na 2.23 bude iontové.HCl lepení na 0.96 bude polární kovalentní a LiI lepení 1.68 bude 50/50 iontové/kovalentní.
největší rozdíl elektronegativity je 3,19, mezi cesiem (0,79) a fluorem (3,98). Výsledná vazba má asi 95 procent iontového charakteru.
