Vlastnosti Kovalentní Sloučeniny
Když jsme mluvili o pevné iontové sloučeniny v Iontové Sloučeniny, jsme zjistili, že jejich vlastnosti se často odvozuje od silné přitažlivosti opačných elektrických nábojů. Nemělo by být překvapením zjistit, že vlastnosti kovalentních sloučenin jsou z velké části způsobeny povahou kovalentních vazeb.
jednou z nejdůležitějších věcí, které je třeba pamatovat na kovalentní sloučeniny, je to, že nejsou iontové. To se zdá zřejmé, ale rozdíl je ve skutečnosti jemnější, než si dokážete představit. Pro ilustraci této koncepce, podívejte se na následující obrázek:
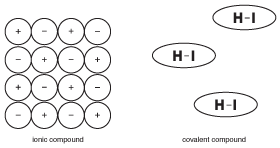
na Rozdíl od iontové sloučeniny, kde všechny ionty ve velkém crystal pomoc, aby se vzájemně drží pohromadě, molekuly kovalentní sloučeniny jsou drženy pohromadě síly, zvané „mezimolekulárních sil,“ které jsou mnohem slabší než chemické vazby (více o mezimolekulární síly v Pevných látkách). Výsledkem je, že molekuly v kovalentní sloučenině nejsou navzájem přitahovány stejně jako ionty v iontových sloučeninách. Tento rozdíl ve struktuře je důležitý pro pochopení vlastností kovalentních sloučenin.
Kovalentní Sloučeniny s Nízkým bodem Tání a Body Varu
Jak bylo uvedeno v Iontové Sloučeniny, velké množství energie je nutné k roztavení iontová sloučenina, protože silné interakce mezi kationty a anionty v iontovém krystalu. V kovalentních sloučeninách jsou však všechny molekuly vázány pouze slabě na sousední molekuly, proto k oddělení kovalentních molekul od sebe vyžaduje velmi málo energie.
Mnoho začátku chemie studenti se mylně domnívají, že když kovalentní molekuly taje, kovalentní vazby jsou rozbité. To je lež. Když se iontové sloučeniny roztaví, iontová přitažlivost selže. Když se kovalentní sloučeniny roztaví, molekuly se jednoduše odtáhnou od sebe a vazby zůstanou neporušené.
kovalentní sloučeniny jsou špatné vodiče
iontové sloučeniny jsou skvělé vodiče elektřiny, když jsou rozpuštěny nebo roztaveny. Jak je uvedeno v iontových sloučeninách, je to proto, že iontové sloučeniny mají mobilní ionty, které jsou schopny přenášet elektrický náboj z jednoho místa na druhé. Také velmi dobře vedou teplo, protože ionty jsou v pořádku vedle sebe, což umožňuje efektivní přenos energie z jednoho místa na druhé.
kovalentní sloučeniny jsou na druhé straně téměř vždy dobrými izolátory elektřiny i tepla. Elektřina není schopna účinně provádět kovalentní sloučeniny, protože neexistují žádné ionty, které by pohybovaly elektrickým nábojem. Vynikajícím příkladem toho je ve vašem vlastním domě, kde je kov v prodlužovacích šňůrách pokryt plastem, aby nedošlo k úrazu vaší kočky elektrickým proudem. Teplo také necestuje dobře kovalentními sloučeninami, protože molekuly nejsou tak pevně drženy k sobě jako ionty v iontové sloučenině, což snižuje účinnost přenosu tepla. To je důvod, proč používáte rukavice bez prstů k vyjmutí cookies z trouby, spíše než k potažení rukou solí.
Kovalentní Sloučeniny Někdy Spálit
Organické sloučeniny jsou kovalentní sloučeniny, které obsahují uhlík. Obvykle také obsahují vodík. a může obsahovat menší množství dalších prvků, jako je dusík, síra,fosfor, kyslík nebo některý z halogenů.
mnoho kovalentních sloučenin je hořlavé a snadno hoří přidáním tepla. Hlavní skupina kovalentních sloučenin, které jsou hořlavé, se nazývají organické sloučeniny. Organické sloučeniny hoří, protože obsahují uhlík a vodík, které se při vysokých teplotách dobře kombinují s kyslíkem.
je důležité mít na paměti, že ne všechny kovalentní sloučeniny hoří?například voda je kovalentní sloučenina a budete mít velmi těžké začít s ohněm. Avšak mnohem kovalentnější než iontové sloučeniny jsou hořlavé.
hořlavost je obecná vlastnost kovalentních sloučenin, protože velká většina známých kovalentních sloučenin je organická. Protože většina organických sloučenin hoří, můžeme to bezpečně uvést jako vlastnost kovalentních sloučenin, i když existuje mnoho kovalentních sloučenin, které nehoří.
výňatek z The Complete Idiot ‚ s Guide to Chemistry 2003 od Iana Gucha. Všechna práva vyhrazena, včetně práva na reprodukci zcela nebo zčásti v jakékoli formě. Používá se po dohodě s Alpha Books, členem Penguin Group (USA) Inc.
Chcete-li objednat tuto knihu přímo od vydavatele, navštivte webové stránky Penguin USA nebo volejte 1-800-253-6476. Tuto knihu si můžete také zakoupit na Amazonu.com and Barnes & Noble.