Periodické trendy a rozpouštědlo účinky v nucleophilicity
Tam jsou předvídatelné periodické trendy v nucleophilicity. Pohybující se vodorovně přes druhém řádku tabulky, trend v nucleophilicity paralely trend v basicity:
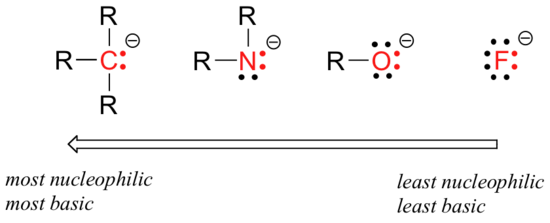
úvaha za horizontálním trendem nukleofility je stejná jako úvaha za trendem bazicity: více elektronegativních prvků drží své elektrony pevněji, a jsou méně schopni je darovat, aby vytvořili novou vazbu.
Tato vodorovná trendy nám také říká, že aminy jsou více nucleophilic než alkoholy, ačkoli obě skupiny často působí jako nucleophiles v obou laboratorních a biochemických reakcí.
připomeňme, že zásaditost atomů klesá, když se pohybujeme svisle dolů sloupcem v periodické tabulce: thiolate ionty jsou menší, než základní alkoxide ionty, například, a bromidový ion je nižší než základní chloridových iontů, což je méně, než základní fluoridových iontů. Připomeňme také, že tento trend lze vysvětlit tím, že vzhledem ke zvyšující se velikosti ‚elektronového oblaku kolem větší ionty: elektronové hustoty vlastní negativní náboj se šíří po větší ploše, což vede ke zvýšení stability (a tím snížit basicity).
vertikální periodický trend nukleofility je poněkud komplikovanější než u bazicity: v závislosti na rozpouštědle, ve kterém reakce probíhá, může trend nukleofility jít v obou směrech. Vezměme si jednoduchý příklad SN2 reakce níže:
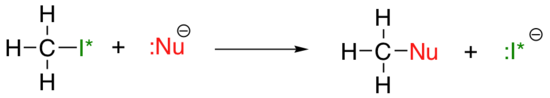
. . .kde je Nu – je jedním z halogenidových iontů: fluorid, chlorid, bromid, či jodid, a odstupující skupina I* je radioaktivní izotop jódu (což nám umožňuje rozlišit odchodu skupiny z nukleofil, že v případě, kdy jsou oba jodid). Pokud se tato reakce se objevuje v protická rozpouštědla (to znamená, že rozpouštědlo, které má vodík vázaný na kyslík nebo dusík – voda, methanol a ethanol jsou nejdůležitější příklady), pak reakce bude jít nejrychlejší, když jodid je nukleofil, a nejpomalejší, když fluorid je nukleofil, což odráží relativní sílu nukleofil.

Relativní nucleophilicity v protické rozpouštědlo,
samozřejmě, To je opačný, že z vertikálních pravidelných trend pro basicity, kde jodid je alespoň základní. Co se to tu děje? Neměla by být silnější báze se svými reaktivnějšími valenčními elektrony také silnější nukleofil?
jak bylo uvedeno výše, vše souvisí s rozpouštědlem. Pamatujte, že nyní mluvíme o reakci probíhající v protickém rozpouštědle, jako je ethanol. Protická rozpouštědla, molekuly tvoří velmi silnou ion-dipól interakce s negativně nabitou nukleofil, v podstatě vytváří ‚rozpouštědlo klec kolem nukleofil.

aby pro nukleofil k útoku na elektrofilem, musí vymanit, alespoň v části, od jeho klece rozpouštědla. Osamělé dvojice elektronů na větší, méně základní jodid ion komunikovat méně pevně s protony na protická rozpouštědla, molekuly – tedy jodid nukleofil je lépe schopen vymanit se z jeho klece rozpouštědla ve srovnání menší, více základní fluoridových iontů, jehož osamělý pár elektrony jsou vázány pevněji protony z klece.
obraz Se změní, když jsme přejít na polární aprotická rozpouštědla, jako je aceton, ve kterém je molekulární dipól, ale žádné vodíky vázané na kyslík nebo dusík. Fluorid je nejlepší nukleofil a jodid nejslabší.
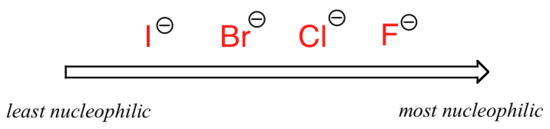
Relativní nucleophilicity v polární aprotická rozpouštědla
důvodem pro zrušení je, že s aprotická rozpouštědla, ion-dipól interakce mezi rozpouštědlem a nukleofil jsou mnohem slabší: pozitivní end rozpouštědla je dipól je skrytý v interiéru molekuly, a proto je chráněn před negativní náboj na nukleofil.
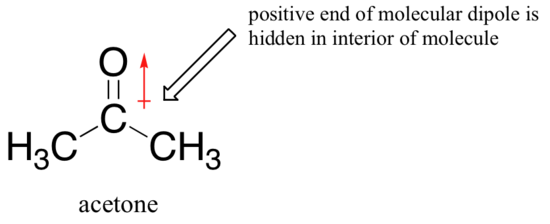
slabší rozpouštědlem-nukleofil interakce znamená slabší rozpouštědla klec pro nukleofil prorazit, takže rozpouštědla, účinek je mnohem méně důležité, a více základní fluoridových iontů je také lepší nukleofil.
proč pro tuto reakci nepoužívat zcela nepolární rozpouštědlo, jako je hexan, aby byla klec rozpouštědla zcela eliminována? Odpověď na tuto otázku je jednoduchá – nukleofil musí být v řešení s cílem reagovat na znatelný rychlost s elektrofilem, a rozpouštědla jako hexan nebude solvate a nabité (nebo vysoce polární) nukleofil. To je důvod, proč chemici používají polární aprotická rozpouštědla pro nucleophilic substituční reakce v laboratoři: jsou dostatečně polární solvate na nukleofil, ale ne tak polární, jako je zamknout pryč v neproniknutelné klece rozpouštědla. Kromě acetonu jsou další tři běžně používaná polární aprotická rozpouštědla acetonitril, dimethylformamid (DMF) a dimethylsulfoxid (DMSO).
V biologické chemii, kde protická rozpouštědla (vody), nejdůležitější implikace periodické trendy v nucleophilicity je, že thioly jsou silnější nucleophiles než alkoholy. Na thiol skupina cystein aminokyselin, například, je silný nukleofil a často se chová jako nukleofil v enzymatické reakce, a samozřejmě negativně nabité thiolates (RS -), jsou i více nucleophilic. Tím nechci říci, že hydroxylové skupiny na serinu, threoninu a tyrosinu také nepůsobí jako nukleofily-Ano .