Cíle
- Známé a neznámé roztoky kovových iontů \(\ce{Ag^{+}}\), \(\ce{Fe^{3+}}\), \(\ce{Co^{2+}}\), \(\ce{Cu^{2+}}\) a \(\ce{Hg^{2+}}\) budou analyzovány pomocí papírové chromatografie.
- Neznámý roztok obsahující některé z těchto kationtů bude identifikován porovnáním s hodnotami Rf a barvami obarvených skvrn známých roztoků.
většina chemiků a mnoho dalších vědců musí běžně oddělit směsi a identifikovat jejich složky. Schopnost kvalitativně identifikovat látky nalezené ve vzorku může být kritická. Například environmentální chemik zkoumající vzorky znečištěné podzemní vody bude chtít vědět, které toxické ionty mohou být ve vzorku přítomny.
chromatografie je jedním z prvních nástrojů používaných v takových situacích. V této technice, mnoho typů směsí mohou být rozděleny do složky čistých látek; ve srovnání se standardním vzorkem lze každou složku látky také předběžně identifikovat.
existuje mnoho druhů chromatografie, každá z nich je určena k oddělení specifických typů směsí. Společným rysem každého typu chromatografie je to, že mobilní fáze (kapalina nebo plyn) je tlačena stacionární fází (pevná látka). Tabulka 1 uvádí několik druhů chromatografie a typické identity fází. V tomto experimentu bude použita papírová chromatografie.
|
Type of Chromatography |
Mobile Phase |
Stationary Phase |
|---|---|---|
|
Gas (GC) |
inert gas (helium) |
waxy liquid or silicone inside narrow tubing |
|
Liquid |
solvent/solvent Mixture (organic or aqueous) |
solid packing (silica, alumina) |
|
Paper |
solvent/solvent Mixture (organic or aqueous) |
paper |
|
Thin-Layer (TLC) |
solvent/solvent Mixture (organic or aqueous) |
silica/alumina coated glass, plastic or metal |
příklad sloupcové chromatografie (Obrázek 1) ukazuje typické rysy nalezené v této analytické technice. Diagram ukazuje experiment, kde je dvousložková směs podrobena sloupcové chromatografii. Kolona je naplněna pevným materiálem nazývaným stacionární fáze. Kapalné rozpouštědlo nebo eluční roztok se nalije do kolony a zcela navlhčí pevný obalový materiál. Poté se směs nalije na horní část mokré kolony a přidá se další eluent. Gravitace táhne mobilní fázi dolů stacionární fází a složky ve směsi se začnou pohybovat kolonou různými rychlostmi. V diagramu, složka A se pohybuje rychleji než složka B; tedy složka B je zachována na sloupec po delší dobu, než složka A. Obvykle to je vzhledem k rozdílu v rozpustnosti obou látek v rozpouštědle a/nebo rozdíl v přitažlivosti k pevné balení materiálu. Když se do horní části sloupce přidá více eluentu, komponenty nakonec opustí sloupec Samostatně. Čas potřebný k výstupu kolony, tzv. retenční čas, bude reprodukovatelné pro každou komponentu pod danou sadu podmínek—mobilní a stacionární fází identity, teplota a šířku sloupce. Jakmile složky opustí kolonu, rozpouštědlo může být odstraněno odpařením a čisté složky mohou být dále analyzovány nebo identifikovány.
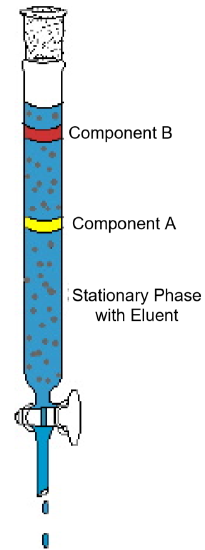
Obrázek 1: typický sloupcový chromatografický experiment demonstruje separaci dvousložkové směsi.
Orientační identifikaci složek může být dosaženo porovnáním neznámých směs pečlivě připravené známé směsi: pokud je známo, že složka má stejný retenční čas jako neznámé komponenty za stejných podmínek, je pravděpodobné, ale není rozhodující—že obě složky jsou stejné. K potvrzení této hypotézy může být zapotřebí další analýza. Pokud mají známé a neznámé různé retenční časy, pak není pravděpodobné, že tyto dvě složky jsou identické.
jiné varianty chromatografie používají kapilární působení-přitahování kapaliny k pevnému povrchu-k protažení rozpouštědla pevným materiálem. Neformální verze papírové chromatografie může být pozorována, když inkoustová stránka přichází do styku s vodou nebo jinými kapalinami. Inkoust běží a několik barev je odděleno v pruhu inkoustu.
níže uvedený diagram (Obrázek 2) ukazuje výsledek tenkovrstvého chromatografického experimentu. Dvě černé inkoustové skvrny na pevném povrchu prošly rozpouštědlem. Rozpouštědlem je voda nebo jiná kapalina, která je tažena stacionární fází kapilárním působením. V tomto příkladu se jako stacionární fáze použije kus plastu potažený práškovou pevnou látkou. Alternativně může být jako stacionární fáze použit kus filtračního papíru. Experiment ukazuje, že černý inkoust je směs obsahující několik různých barevných látek. Každá složka má v mobilní fázi mírně odlišnou rozpustnost, takže když je kapalina tažena stacionární fází, každá složka se pohybuje jinou rychlostí a odděluje inkoust na skvrny různých barev.

Obrázek 2: tenkovrstvá chromatografie černého inkoustu po vývoji. Tento obrázek ukazuje běžný problém, kdy se skvrny rozšiřují, když se pohybují po desce, nakonec se spojí v horní části desky.
v tomto experimentu se podobné principy používají k oddělení několika kovových kationtů metodou papírové chromatografie. Kovové ionty—\(\ce{Ag^{+}}\), \(\ce{Fe^{3+}}\),\(\ce{Co^{2+}}\), \(\ce{Cu^{2+}}\) a \(\ce{Hg^{2+}}\)—mají rozdílné rozpustnosti v mobilní fázi—vodné \(\ce{HCl}\) s ethyl a butyl alkohol—a bude se pohybovat v různých sazeb papír. Různé kovové-ion rozpustností jsou pravděpodobně v důsledku tvorby různých sloučenin s chloridovými ionty a jejich různé schopnosti rozpouštět se v organických rozpouštědlech.
schéma znázorňující přípravu papíru je uvedeno níže. Standardní roztoky obsahující každý z těchto iontů budou na papír spatřeny pomocí kapilární trubice spolu se standardním roztokem obsahujícím všech pět iontů. Na papír bude také spatřen Neznámý. Jakmile je papír připraven, bude vyvinut umístěním papíru do eluentu. Po 75-90 minutách se papír vizualizuje navlhčením vodným roztokem obsahujícím jodid draselný, \(\ce{ki}\) a ferrokyanid draselný, \(\ce{K4}\). Jedinečná barva pozorovaná pro každý iont je produkována chemickou reakcí s vizualizačním roztokem. To je jeden užitečný způsob, jak zjistit, které ionty jsou přítomny v neznámé směsi.
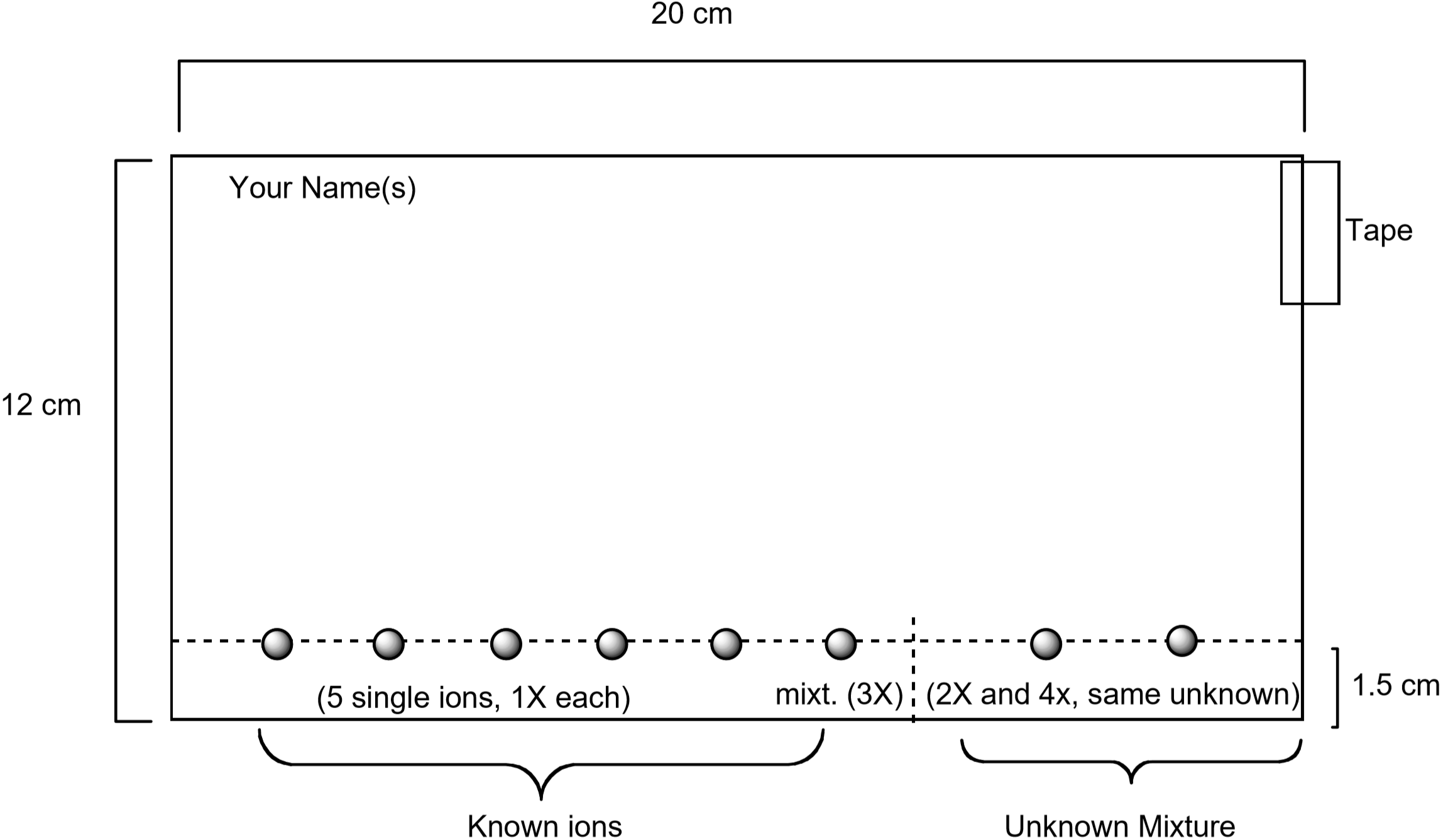
obrázek 3: schéma, jak připravit papír pro chromatografický experiment
vzdálenost, kterou se ion pohybuje nahoru, může být také použita k identifikaci iontu. Nicméně, protože studenti budou rozvíjet své chromatografie experimenty pro různé množství času a za mírně odlišných podmínek, každý student bude mít poněkud odlišné měřené vzdálenosti pro daný ion. Poměr vzdálenosti dojat ion (\(D\)) ujetá vzdálenost rozpouštědlem (\(F\), čelo rozpouštědla) je charakteristické a měly by být téměř stejné pro všechny studenty. Tento poměr se nazývá Rf nebo “ retenční faktor.“
\
postup
materiály a zařízení
chemikálie: 0. 1 M vodné roztoky \(\ce{AgNO3}\), \(\ce{Hg(NO3)2}\), \(\ce{Fe(NO3)3}\), \(\ce{Co(NO3)2}\) a \(\ce{Cu(NO3)2}\), každý s vyhrazenou kapilární trubičky; eluční roztok (vodný \(\ce{HCl}\) s ethyl a butyl alkohol); vizualizace řešení (vodný roztok \(\ce{KI}\) a \(\ce{K4}\)).
Vybavení: Čistý kus chromatografie papír; jednorázové Latexové rukavice (nitrilové rukavice jsou k dostání ve skladu pro lidi s alergiemi na Latex); 600 mL kádinky; plastové fólie; kleště nebo kleště, kádinka; pravítko *
*Položky získané ze skladu
Bezpečnost
Vyhněte se kontaktu s iontem kovu řešení, elučního rozpouštědla, a vizualizaci řešení. Používejte jednorázové rukavice, abyste se dotkli chromatogramu poté, co dojde k eluci, a po zbytek experimentu. Nevdechujte výpary eluačního rozpouštědla nebo vizualizačního roztoku. Umístěte mokrý chromatogram na papírový ručník, nikoli přímo na laboratorní lavici. Vizualizační řešení používejte pouze v prostoru poskytnutém Vaším instruktorem. Po ukončení experimentu zlikvidujte rukavice a chromatogram ve specifikované nádobě na odpad. Po kontaktu se všemi roztoky v této laboratoři si důkladně umyjte ruce.
Příprava papíru pro chromatografii
- Každý pár by studenti měli získat kousek filtračního papíru s rozměry podle Obrázku 3. Ujistěte se, že je papír čistý a bez slz nebo záhybů. Pomocí tužky—nikoli pera-a pravítka nakreslete čáru přes papír jeden cm od dlouhého okraje papíru. Na této lince uvidíte roztoky kovových iontů. Napište své jméno tužkou do levého horního rohu papíru.
- Procvičte si nanášení vody a / nebo iontových roztoků na proužek filtračního papíru, abyste věděli, jak vytvořit skvrny správné velikosti. Použijte skleněné kapilární trubice k nalezení iontů na papíře. Roztok se aplikuje lehkým a rychlým dotykem kapilární trubice obsahující roztok na čáru, kterou jste nakreslili na papír. Skvrny by měly mít průměr 5-8 mm. Skvrny větší než toto se během experimentu nadměrně rozloží a ztěžují analýzu.
- známý 0.1 M vodné roztoky \(\ce{AgNO3}\), \(\ce{Hg(NO3)2}\), \(\ce{Fe(NO3)3}\), \(\ce{Co(NO3)2}\) a \(\ce{Cu(NO3)2}\) jsou k dispozici ve zkumavkách, každá obsahující dva nebo tři kapilární trubky. Začněte vlevo, tužkou označte identitu iontu pod každým bodem; poté každý známý ion opatrně na čáru. Dávejte pozor, abyste zabránili kontaminaci kapilární trubice jinými ionty a vyměňte kapilární trubice zpět do správné zkumavky. Zkumavka obsahující známou směs všech pěti iontů je rovněž opatřena sadou kapilárních trubic. Spot tuto směs na lince stejně. Protože toto řešení je více zředěný než jeden-ion známé řešení, aplikovat známé směs třikrát, nechat místo vyschnout mezi každou aplikaci. Tepelná lampa pomůže rychleji vysušit místo.
- ve zkumavkách je také několik neznámých, spolu s kapilárními zkumavkami. Váš instruktor vám řekne, které neznámé by měly být použity. Neznámé budou obsahovat jeden až čtyři kationty a jsou zředěnější než jedno iontové známé roztoky. Neznámý bude také muset být aplikován dvakrát a čtyřikrát pro dvě zkoušky, nechat místo zaschnout mezi každou aplikací. V případě chyby byste měli neznámého najít na dvou místech podél linie, aby byly k dispozici dvě studie pro analýzu.
Rozvoj chromatografie papír
- Umístěte kus pásky podél horního pravého okraje, jak je znázorněno na Obrázku 3. Poté vytvořte válec spojením dvou krátkých okrajů papíru s páskou. Ujistěte se, že se okraje nedotýkají. Papír by měl vypadat podobně jako obrázek 4.
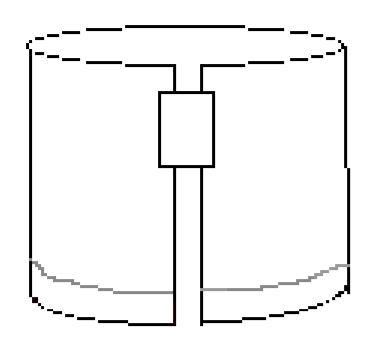
obrázek 4: skládaný papír by měl vypadat takto před vývojem experimentu.
- získá se 15 mL eluačního roztoku. Opatrně nalijte trochu tohoto rozpouštědla do 600 mL kádinky a opatrně krouživým pohybem za sekundu nebo dvě. Upozornění: Nevdechujte páry z tohoto roztoku! Ujistěte se, že hladina kapaliny bude pod bodovou čarou na papíře, jakmile je papír umístěn do vyvíjející se Komory.
- vložte papírovou lahvičku do kádinky s vyznačeným okrajem dolů. Skvrny by měly být nad hladinou rozpouštědla. Papír by se neměl dotýkat stran kádinky. Opatrně zakryjte kádinku plastovým obalem a vložte ji do kapoty po dobu 75-90 minut. Rozpouštědlo by se mělo začít pohybovat po papíru. Jakmile je kádinka zakryta, ujistěte se, že je vyrovnaná a během vývojového období ji nerušte. Váš instruktor může mít úkol pro vás pracovat na počkání.
Vizualizaci a analýzu papíru
- Jakmile vývojové období je u konce, používejte jednorázové rukavice a vyjměte papír z kádinky. Latexové rukavice jsou k dispozici v laboratoři a nitrilové rukavice jsou k dispozici ve skladu pro lidi s alergií na Latex. Nechte jakékoli rozpouštědlo kapat zpět do kádinky a poté pásku vyjměte. Položte chromatografický papír na papírový ručník a tužkou okamžitě označte přední část rozpouštědla. Použité eluční rozpouštědlo nalijte do dodané nádoby na odpad. Papír vysušte pod tepelnou lampou v kapotě. Opatrnost: Nevdechujte výpary! Dávejte pozor, abyste papír nespálili pod lampou.
- jakmile je papír suchý, přiveďte jej do vizualizační stanice na papírovém ručníku. Krátce ponořte papír do vizualizačního roztoku umístěného v mělké misce v digestoři. Okamžitě vyjměte papír z roztoku a nechte přebytečný odkapat na stanici. Umístěte mokrý papír na suchý papírový ručník a okamžitě jej osušte pod tepelnou lampou a poté jej přeneste na lavičku pro analýzu.
- nejprve najděte všechny známé jedno ionty a zaznamenejte barvy, které pozorujete. Některá místa mohou časem vyblednout, takže zaznamenávejte barvy, dokud je papír stále mokrý. Změřte vzdálenost každé místo pohyboval, D, s pravítkem. Změřte do středu každého místa. Zaznamenejte svá data do datové tabulky.
- změřte vzdálenost k přední straně rozpouštědla, F. hodnota F by měla být přibližně stejná na celém papíru. Tyto hodnoty použijte k výpočtu Rf pro každý iont. Proveďte měření, jak je znázorněno na obrázku 5. Každé pozorované místo má svou vlastní hodnotu Rf. Zaznamenejte své výsledky do datové tabulky.
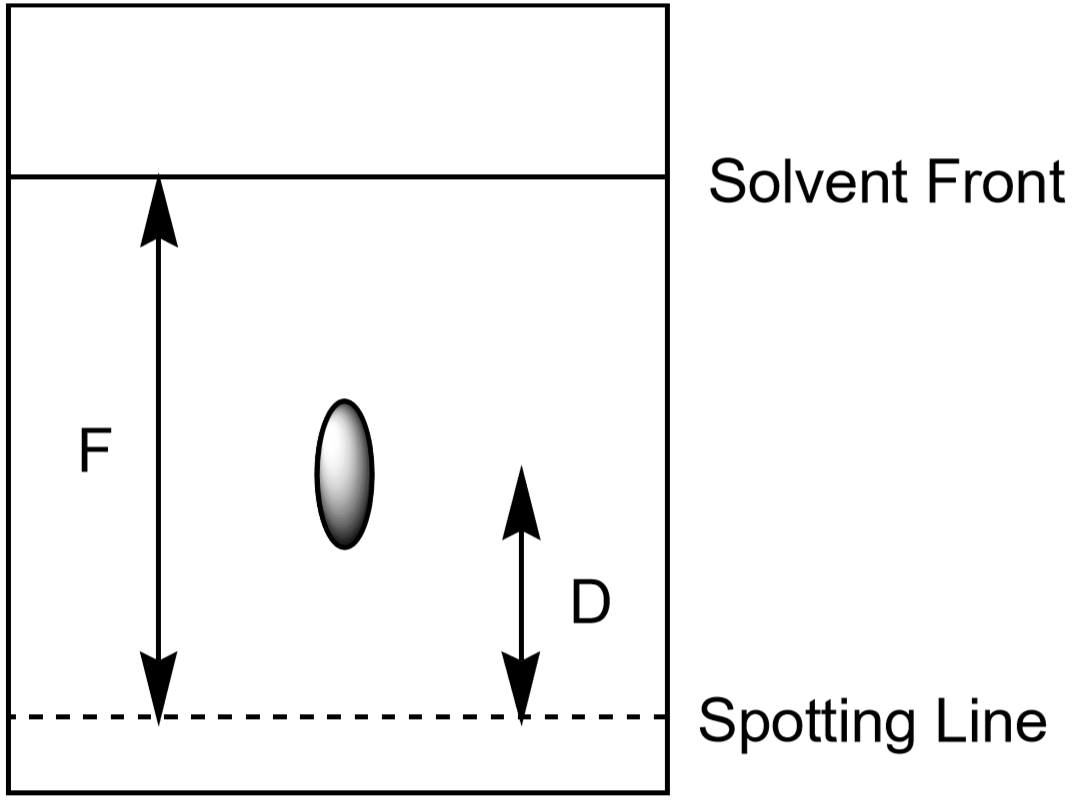
obrázek 5: Měření vzdáleností použitých při výpočtu Rf pro místo.
- v pruhu obsahujícím směs najděte každý iont a zaznamenejte vzdálenost, kterou každý iont pohybuje. Vypočítejte Rf pro každý iont v tomto pruhu. Hodnoty by se měly přesně shodovat s hodnotami pozorovanými u jedno iontových knowns.
- v pruhu obsahujícím neznámé vyhledejte střed každého pozorovaného místa a zaznamenejte jeho vzdálenost a Vypočítejte hodnoty Rf. Použijte pruh, který má nejjasnější místa. Hodnoty barvy a Rf pro neznámá místa by se měly úzce shodovat s některými známými ionty. Nyní byste měli být schopni určit, které ionty nebo ionty se nacházejí ve vašem neznámém. Zaznamenejte svá data do odpovídající tabulky.
- vytvořte náčrt chromatogramu v prostoru uvedeném ve formuláři laboratorní zprávy a nezapomeňte uvést polohu a přibližnou velikost a tvar každého místa na papíře. Papír zlikvidujte v určené nádobě na odpad.
vyčištění
vložte chromatografický papír a použité rukavice do dodané nádoby na odpad. Použitý eluční roztok měl být již umístěn do jiné nádoby na odpad. Všimněte si, že pro tento experiment jsou k dispozici dva různé kontejnery na odpad, takže si přečtěte štítky, abyste použili ten správný! Před opuštěním laboratoře si důkladně umyjte ruce.
Pre-laboratorní Úkol: papírová Chromatografie
- dvousložková směs je analyzována pomocí papírové chromatografie. Složka a je rozpustnější v mobilní fázi než složka B. získá se následující výsledek. Vypočítejte Rf pro každou komponentu a označte identitu každého místa.
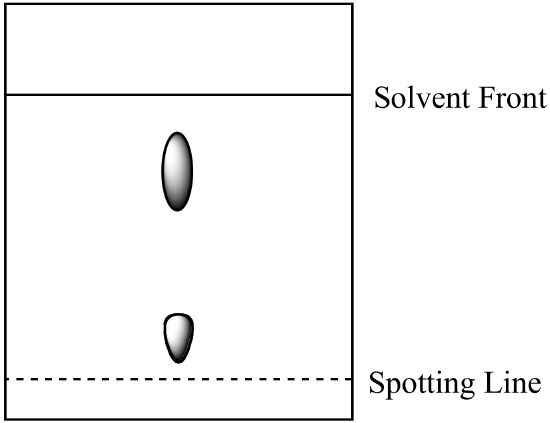
- směs z otázky 1 (výše) se analyzuje sloupcovou chromatografií za použití stejné mobilní fáze a stacionární fáze silikagelu. Která složka má kratší dobu uchovávání? Vysvětlete svou odpověď. (Předpokládejme, že stejný typ vazebných sil mezi složkami a stacionární fází je přítomen jak v papírové chromatografii, tak v kolonové chromatografii.)
- Neznámý vzorek kapaliny se analyzuje pomocí papírové chromatografie za použití rozpouštědla X jako mobilní fáze. Po vytvoření a vizualizaci destičky je pozorováno jedno místo. Stejná neznámá látka se znovu analyzuje pomocí rozpouštědla Y jako mobilní fáze. Tentokrát jsou po vývoji a vizualizaci desky pozorovány tři skvrny.
- je Neznámý vzorek čistou látkou nebo směsí? Vysvětlete svou odpověď, včetně možného důvodu různých pozorování ve dvou experimentech.
Lab Report for Paper Chromatography
Data, Observations, Calculations and Analysis Known Ions
Known Ions
|
Ion |
Spot Color (Stained) |
D (Single- Ion) |
F (Single- Ion) |
Rf |
D (Ion Mixt.) |
F (Ion Mixt.) |
Rf |
|---|---|---|---|---|---|---|---|
|
\(\ce{Ag^{+}}\) |
|||||||
|
\(\ce{Co^{2+}}\) |
|||||||
|
\(\ce{Cu^{2+}}\) |
|||||||
|
\(\ce{Fe^{3+}}\) |
|||||||
|
\(\ce{Hg^{2+}}\) |
Unknown ID Code _________________
Unknowns
|
Spot Number (from lowest Rr) |
Spot Color (Stained) |
D (Unknown) |
F (Unknown) |
Rf |
Identity of Spot |
|---|---|---|---|---|---|
- Sketch of Chromatogram:
Summary:
| Neznámé ID | Identifikovány Ionty |
|---|---|
Otázky a Závěry
- Jaká kritéria byla použita k identifikaci ion(y) ve vaší neznámý? Vysvětlete svou odpověď alespoň ve třech větách. Zahrňte jakékoli potíže při identifikaci iontů.
- pokud necháte experiment běžet pouze 30 minut, jaký by byl pravděpodobný výsledek? Vznikly by nějaké problémy při identifikaci neznámého?
- Pokud by \(\ce{Co^{2+}}\) A \(\ce{Cu^{2+}}\) skvrny měly stejnou barvu, byla by identifikace neznámého obtížnější? Vysvětlete svou odpověď.