Video \(\PageIndex{1}\): stručný úvod do genialitu Mendělejeva.
jak časní chemici pracovali na čištění rud a objevili více prvků, uvědomili si, že různé prvky mohou být seskupeny podle jejich podobného chemického chování. Jedno takové seskupení zahrnuje lithium (Li), sodík (Na) a draslík (k): Všechny tyto prvky jsou lesklé, dobře vedou teplo a elektřinu a mají podobné chemické vlastnosti. Druhé seskupení obsahuje vápník (Ca), stroncium (Sr), baryum (Ba), které jsou také lesklé, dobré vodiče tepla a elektřiny a chemické vlastnosti společné. Specifické vlastnosti těchto dvou seskupení se však od sebe výrazně liší. Například: Li, Na A K jsou mnohem reaktivnější než Ca, Sr a Ba; Li, Na, A K tvoří sloučeniny s kyslíkem v poměru dvou jejich atomů k jednomu atomu kyslíku, zatímco Ca, Sr, a Ba tvoří sloučeniny s jedním z jejich atomů k jednomu atomu kyslíku. Fluor (F), chlor (Cl), brom (Br) a jod (I) také vykazují podobné vlastnosti, ale tyto vlastnosti se drasticky liší od vlastností kteréhokoli z výše uvedených prvků.
Dimitrij Mendělejev v Rusku (1869) a Lothar Meyer v Německu (1870) nezávisle na sobě poznal, že tam byl pravidelný vztah mezi vlastnostmi prvků, známé v té době. Obě publikované tabulky s prvky uspořádanými podle zvyšující se atomové hmotnosti. Ale Mendeleev šel o krok dále než Meyer: použil svůj stůl k předpovědi existence prvků, které by měly vlastnosti podobné hliníku a křemíku, ale dosud nebyly známy. Objevy Gallia (1875) a germania (1886) poskytly Mendeleevově práci velkou podporu. Ačkoli Mendeleev a Meyer měli dlouhý spor o prioritu, Mendeleevovy příspěvky k vývoji periodické tabulky jsou nyní široce uznávány (obrázek \(\PageIndex{1}\)).
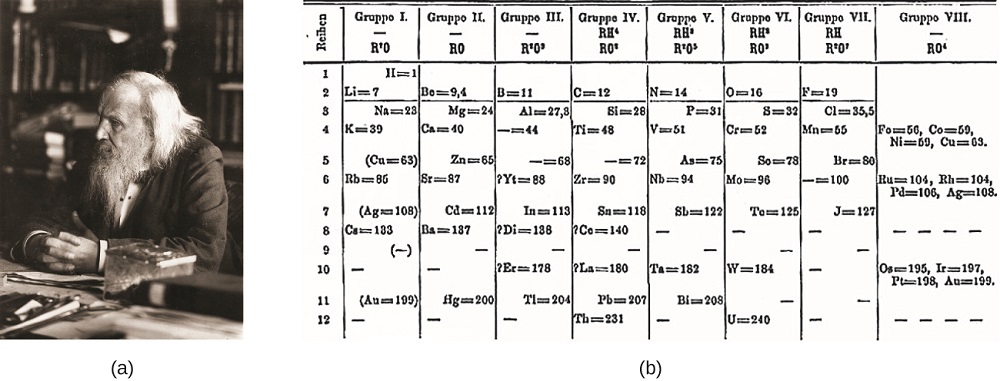
obrázek \(\PageIndex{1}\): (a) Dimitri Mendělejev je široce připočítán s vytvořením (b) první periodické tabulky prvků. (kredit: úprava práce Serge Lachinov; credit b: změna práce „Den fjättrade ankan“/Wikimedia Commons)
Video \(\PageIndex{2}\): úvod do organizace periodické tabulky do period a skupin. Tato organizace bude důležitá, protože budeme i nadále stavět na principech chemie.
ve dvacátém století se ukázalo, že periodický vztah zahrnoval spíše atomová čísla než atomové hmoty. Moderní prohlášení tohoto vztahu, periodický zákon, je následující: vlastnosti prvků jsou periodické funkce jejich atomových čísel. Moderní periodická tabulka uspořádá prvky ve zvyšujícím se pořadí jejich atomových čísel a seskupí atomy s podobnými vlastnostmi ve stejném svislém sloupci (obrázek \(\PageIndex{2}\)). Každý box představuje prvek a obsahuje jeho atomové číslo, symbol, průměrnou atomovou hmotnost a (někdy) jméno. Prvky jsou uspořádány v sedmi vodorovných řadách, nazývaných periody nebo série, a 18 svislých sloupců, nazývaných skupiny. Skupiny jsou označeny v horní části každého sloupce. Ve Spojených státech byly štítky tradičně číslicemi s velkými písmeny. IUPAC však doporučuje použít čísla 1 až 18 a tyto štítky jsou častější. Aby se tabulka vešla na jednu stránku, jsou části dvou řádků, celkem 14 sloupců, obvykle zapsány pod hlavní částí tabulky.

Obrázek \(\PageIndex{2}\): Prvky v periodické tabulce jsou uspořádány podle jejich vlastností.
mnoho prvků se dramaticky liší svými chemickými a fyzikálními vlastnostmi, ale některé prvky jsou podobné svým chováním. Například, mnoho prvků se objeví lesklé, kujné (schopen deformovat bez porušení) a tvárné (lze čerpat do drátů), a vést teplo a elektřinu. Ostatní prvky nejsou lesklé, tvárné nebo tvárné a jsou špatnými vodiči tepla a elektřiny. Můžeme seřadit prvky do velké třídy s společné vlastnosti: kovy (prvky, které jsou lesklé, kujné, dobré vodiče tepla a elektřiny—žlutě); nekovy (prvky, které se objevují nudné, špatné vodiče tepla a elektřiny—ve stínu zelené); a metaloidy (prvky, které vedou teplo a elektřinu poměrně dobře, a mají některé vlastnosti kovů a některé vlastnosti nekovů—stínované fialová).
prvky, které mohou být rovněž zařazeny do hlavní skupiny prvků (nebo zástupce prvků) ve sloupcích označených 1, 2, a 13-18; přechodné kovy ve sloupcích označené 3-12; a vnitřní přechodné kovy ve dvou řadách v dolní části tabulky (horní řádek prvky se nazývají lanthanoidy a spodní řádek prvky jsou aktinidy; Číslo \(\PageIndex{3}\)). Prvky mohou být dále rozděleny podle specifičtějších vlastností, jako je složení sloučenin, které tvoří. Například prvky ve skupině 1 (první sloupec) tvoří sloučeniny, které se skládají z jednoho atomu prvku a jednoho atomu vodíku. Tyto prvky (kromě vodíku) jsou známé jako alkalické kovy a všechny mají podobné chemické vlastnosti. Prvky ve skupině 2 (druhý sloupec) tvoří sloučeniny skládající se z jednoho atomu prvku a dvou atomů vodíku: jedná se o tzv. kovů alkalických zemin, s podobnými vlastnostmi mezi členy této skupiny. Ostatní skupiny se specifickými názvy jsou niktogeny (skupina 15), chalkogeny (skupina 16), halogeny (skupina 17) a vzácné plyny (skupina 18, také známý jako inertní plyny). Skupiny mohou být také označovány prvním prvkem skupiny: například chalcogeny mohou být nazývány kyslíkovou skupinou nebo kyslíkovou rodinou. Vodík je unikátní, nekovový prvek s vlastnostmi podobnými jak prvkům skupiny 1, tak skupině 17. Z tohoto důvodu může být vodík zobrazen v horní části obou skupin nebo sám o sobě.
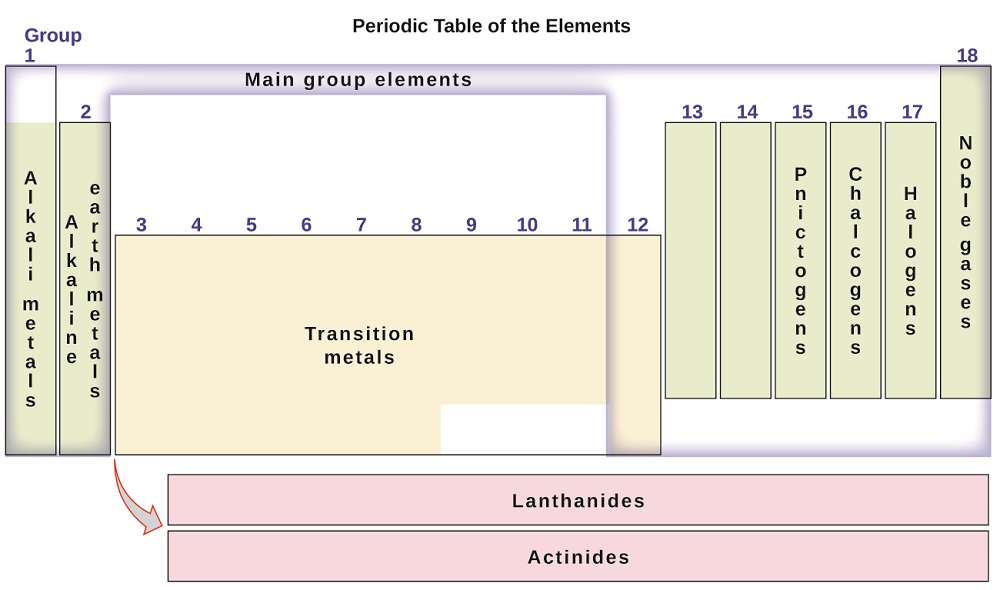
Obrázek \(\PageIndex{3}\): periodická tabulka organizuje prvky s podobnými vlastnostmi do skupin.
příklad \(\PageIndex{1}\): pojmenování skupin prvků
atomy každého z následujících prvků jsou nezbytné pro život. Zadejte název skupiny pro následující prvky:
- chlorine
- calcium
- sodium
- sulfur
Solution
The family names are as follows:
- halogen
- alkaline earth metal
- alkali metal
- chalcogen
Exercise \(\PageIndex{1}\)
Give the group name for each of the following elements:
- krypton
- selen
- barnatý
- lithium
Odpověď
jako vzácný plyn,
Odpověď b
chalcogen
Odpověď c
alkalických zemin,
Odpověď d
alkalických kovů
studium V periodické tabulce, možná jste si všimli něco o atomové hmotnosti některých prvků. Prvek 43 (technecium), prvek 61 (promethium), a většina prvků s atomovým číslem 84 (polonium) a vyšší mají své atomové hmotnosti uvedené v hranatých závorkách. To se provádí pro prvky, které se skládají výhradně z nestabilních radioaktivních izotopů (více o radioaktivitě se dozvíte v kapitole jaderná chemie). Pro tyto prvky nelze určit průměrnou atomovou hmotnost, protože jejich radioizotopy se mohou významně lišit v relativní hojnosti, v závislosti na zdroji, nebo dokonce nemusí V přírodě existovat. Číslo v hranatých závorkách je číslo atomové hmotnosti (a přibližná atomová hmotnost) nejstabilnějšího izotopu tohoto prvku.
Shrnutí
Video \(\PageIndex{3}\): souhrn objev a vlastnosti periodické tabulky.
objev periodické opakování podobných vlastností mezi prvky vedl k vypracování periodické tabulce, v níž jsou prvky uspořádány v pořadí rostoucí atomové číslo v řadách známé jako období a sloupců známý jako skupiny. Prvky ve stejné skupině periodické tabulky mají podobné chemické vlastnosti. Prvky lze klasifikovat jako kovy, metaloidy a nekovy nebo jako prvky hlavní skupiny, přechodné kovy a vnitřní přechodné kovy. Skupiny jsou číslovány 1-18 zleva doprava. Prvky ve skupině 1 jsou známé jako alkalické kovy; ty, ve skupině 2 jsou kovů alkalických zemin; v těch 15 jsou niktogeny; ty, v 16 jsou chalkogeny; ty, v 17 jsou halogeny; a ty, v 18 jsou vzácné plyny.