Vzdělávací Cíle
na konci této části, budete moci:
- Vysvětlit vztahy mezi mikroskopické a makroskopické množství v plynu
- Řešení problémů týkajících se směsi plynů
- Řešení problémů týkajících se vzdálenost a čas mezi molekuly plynu srážky
zkoumali Jsme tlak a teplota na základě jejich makroskopické definice. Tlak je síla dělená oblastí, na kterou je síla vyvíjena, a teplota se měří teploměrem. Můžeme lépe porozumět tlaku a teplotě z kinetické teorie plynů, teorie, která spojuje makroskopické vlastnosti plynů s pohybem molekul, z nichž se skládají. Nejprve uděláme dva předpoklady o molekulách v ideálním plynu.
- existuje velmi velký počet n molekul, všechny identické a každá má hmotnost m.
- molekuly se řídí Newtonovými zákony a jsou v nepřetržitém pohybu, který je náhodný a izotropní, tj.
K odvození ideálního plynu a vztah mezi mikroskopické množství, jako je například energie typické molekuly a makroskopické veličiny jako je teplota, analyzujeme vzorek ideálního plynu v pevné nádoby, o které jsme se další dva předpoklady:
- molekuly jsou mnohem menší než průměrná vzdálenost mezi nimi, takže jejich celkový objem je mnohem menší než z jejich kontejneru (který má objem V). Jinými slovy, bereme van der Waalsovu konstantu b, objem molu molekul plynu, jako zanedbatelný ve srovnání s objemem molu plynu v nádobě.
- molekuly vytvářejí dokonale elastické kolize se stěnami nádoby a navzájem. Další síly, včetně gravitace a atrakcí zastoupená Van der Waalsovy konstanty, jsou zanedbatelné (jak je to nutné pro převzetí isotropy).
srážky mezi molekulami se neobjevují v odvození zákona ideálního plynu. Neruší ani derivaci, protože kolize mezi molekulami pohybujícími se náhodnými rychlostmi dávají nové náhodné rychlosti. Kromě toho, pokud rychlosti molekul plynu v nádobě jsou původně náhodné a izotropní, molekulární kolize jsou tím, co je náhodné a izotropní.
děláme ještě další předpoklady, které zjednodušují výpočty, ale neovlivňují výsledek. Nejprve necháme nádobu obdélníkovou krabici. Za druhé, začneme zvažováním monatomických plynů, těch, jejichž molekuly se skládají z jednotlivých atomů, jako je helium. Pak můžeme předpokládat, že atomy nemají žádnou energii kromě své translační kinetické energie; například nemají rotační ani vibrační energii. (Později jsme diskutovali o platnosti tohoto předpokladu pro skutečné monoatomární plyny a obejít se bez ní, aby zvážila, dvojmocné a polyatomic plynů.)
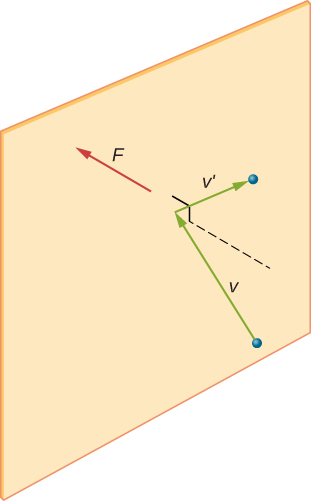
obrázek \(\PageIndex{1}\) ukazuje kolizi molekuly plynu se stěnou nádoby, takže vyvíjí sílu na stěnu (podle Newtonova třetího zákona). Tyto kolize jsou zdrojem tlaku v plynu. Jak se zvyšuje počet molekul, zvyšuje se počet kolizí a tím i tlak. Podobně, pokud je průměrná rychlost molekul vyšší, je tlak plynu vyšší.
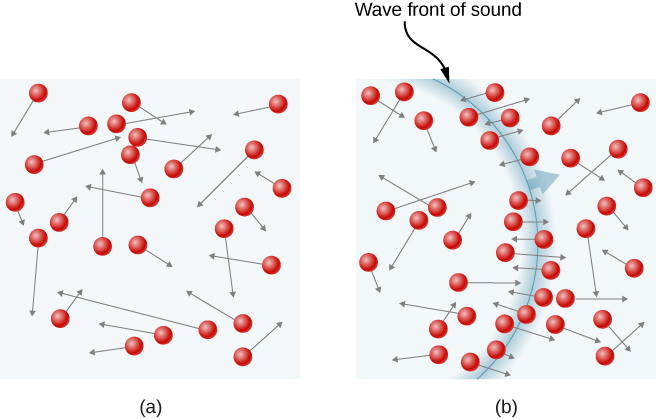
Ve vzorku plynu v nádobě, náhodnosti pohybu molekul způsobuje, že počet srážek molekul s jakoukoliv část stěny v daném čase kolísat. Nicméně, protože obrovské množství molekuly se srazí se stěnou v krátké době, počet kolizí na vahách času a prostoru měříme kolísá pouze o malý, obvykle nepozorovatelné zlomek z průměru. Tuto situaci můžeme přirovnat k situaci kasina, kde jsou výsledky sázek náhodné a tržby kasina kolísají o minutu a hodinu. Nicméně, po dlouhou dobu, jako je rok, tržby kasina jsou velmi blízké průměrům očekávaným z kurzů. Nádrž plynu má enormně více molekul než kasino má sázející za rok, a molekuly dělají enormně více kolizí za sekundu než kasino má sázky.
výpočet průměrné síly vyvíjené molekulami na stěnách krabice nás vede k ideálnímu zákonu plynu a ke spojení mezi teplotou a molekulární kinetickou energií. (Ve skutečnosti, jsme bude trvat dva průměry: jeden v průběhu času, aby se průměrná síla, kterou působí jedna molekula s danou rychlost, a pak další průměr za molekuly s různými rychlostmi.) Tento přístup vyvinul Daniel Bernoulli (1700-1782), který je nejlépe známý ve fyzice pro svou práci na toku tekutin (hydrodynamika). Pozoruhodně, Bernoulli udělal tuto práci předtím, než Dalton založil pohled na hmotu jako sestávající z atomů.
Obrázek \(\PageIndex{2}\) ukazuje kontejner plný plyn a rozšířil pohled z elastické srážce molekuly plynu se stěnou nádoby, rozdělené do složek. Předpokládali jsme, že molekula je malá ve srovnání s oddělením molekul v plynu a že její interakce s jinými molekulami může být ignorována. Za těchto podmínek je zákon o ideálním plynu experimentálně platný. Proto jsme také předpokládali, že stěna je pevná a částice jsou body, srážka je pružná (o zachování energie—nikde na částice kinetickou energii jít). Kinetická energie molekuly proto zůstává konstantní, a proto i její rychlost a velikost hybnosti zůstávají konstantní. Tento předpoklad není vždy platný, ale výsledky ve zbytku tohoto modulu jsou také získány v modelech, které umožňují molekulám vyměňovat energii a hybnost se stěnou.
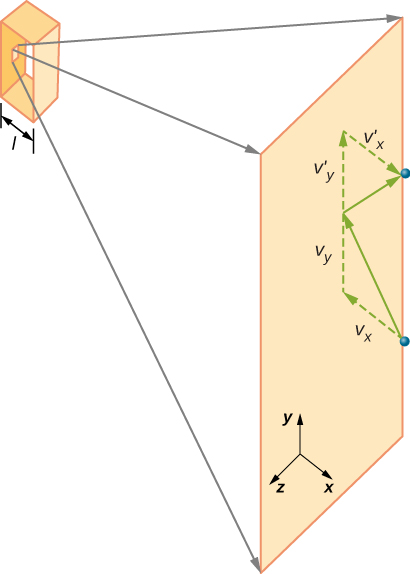
Pokud se rychlost molekuly změní ve směru x, změní se její hybnost z \(- m_x\) na \(+mv_x\). Jeho změna hybnosti je tedy \(\Delta mv = +mv_x – (- mv_x) = 2mv_x\). Podle impuls-impuls věty uvedené v kapitole o lineární dynamiku a kolize, síla působící na i-tý molekuly, kde jsem štítky molekuly od 1 do N, je dána vztahem \
(V této rovnici sám, p je hybnost, ne tlak.) Mezi stěnou a molekulou není žádná síla, kromě doby, kdy se molekula dotýká stěny. Během krátké doby srážky je síla mezi molekulou a stěnou relativně velká, ale to není síla, kterou hledáme. Hledáme průměrnou sílu, takže vezmeme \(\Delta t\) jako průměrnou dobu mezi srážkami dané molekuly s touto stěnou, což je čas, ve kterém očekáváme, že najdeme jednu kolizi. Nechť l představují délku pole ve směru x. Pak \(\Delta t\) je čas, molekuly by se jít přes pole a zpět, vzdálenost 2l, rychlostí \(v_x\). Tak \(\delta t = 2l / v_x\) a výraz pro sílu se stává
\
tato síla je způsobena jednou molekulou. Abychom našli celkovou sílu na stěně, F, musíme přidat příspěvky všech molekul N:
\
nyní používáme definici průměru, kterou označujeme barem, abychom našli sílu:
\
chceme sílu z hlediska rychlosti v, spíše než x-složku rychlosti. Všimněte si, že celková rychlost na druhou je součet čtverců jejích složek, tak, že
\
S předpokladem isotropy, tři průměry na pravé straně jsou stejné, takže
\
Dosazením do výrazu pro F dává
\
tlak je F/A, takže získáme
\, kde jsme použili \(V = Al\) pro objem. To dává důležitý je výsledek,
\
Kombinací této rovnice s \(pV = Nk_BT\) dává
\
můžeme se průměrná kinetická energie na molekulu, \(\frac{1}{2}m\overline{v}^2\) z levé strany rovnice vydělením z N a násobení 3/2.
Průměrná Kinetická Energie na Molekulu.
průměrná kinetická energie molekuly je přímo úměrná jeho absolutní teplotě:
\
rovnice \(\overline{K} = \frac{3}{2} k_BT\) je průměrná kinetická energie na molekulu. Zejména si všimněte, že nic v této rovnici nezávisí na molekulové hmotnosti (nebo jiné vlastnosti) plynu, tlaku nebo cokoli jiného než na teplotě. Pokud jsou vzorky helia a xenonového plynu s velmi odlišnými molekulovými hmotami při stejné teplotě, mají molekuly stejnou průměrnou kinetickou energii.
vnitřní energie termodynamického systému je součtem mechanických energií všech molekul v něm. Nyní můžeme dát rovnici pro vnitřní energii monatomického ideálního plynu. V takovém plynu je jedinou energií molekul jejich translační kinetická energie. Proto, označující vnitřní energii \(E_{int}\) musíme prostě \(E_{int} = N\overline{K}\), nebo
\
Často bychom chtěli tuto rovnici použít, pokud jde o mateřská znaménka:
\
můžeme vyřešit \(\overline{K} = \frac{1}{2}m\overline{v}^2 = \frac{3}{2}k_BT\) pro typické rychlosti molekul v ideálním plynu z hlediska teploty k určení, co je známé jako root-mean-square (rms) rychlosti molekuly.
RMS Rychlost Molekuly
root-mean-square (rms) rychlost molekuly, nebo odmocnina z průměrného čtverce rychlosti \(\overline{v}^2\), je
\
rms rychlost není průměrná nebo nejpravděpodobnější rychlost molekul, jak uvidíme v Rozdělení Molekulárních Rychlostí, ale poskytuje snadno vypočítat odhad molekuly rychlostí, která souvisí s jejich kinetickou energii. Opět můžeme napsat tuto rovnici z hlediska plynové konstanty R a molární hmotnosti M v kg / mol:
\
Jsme na chvíli odbočit odpověď na otázku, která může mít došlo k: Když jsme se použít model s atomy místo teoretické bodové částice, rotační kinetická energie změnit naše výsledky? Abychom odpověděli na tuto otázku, musíme apelovat na kvantovou mechaniku. V kvantové mechanice, rotační kinetická energie nemůže vzít jen tak nějaké hodnoty, je omezena na diskrétní množinu hodnot, a nejmenší hodnota je nepřímo úměrná momentu setrvačnosti. Rotační setrvačnost atomu je malá, protože téměř veškerá jeho hmotnost je v jádru, které má obvykle poloměr menší než \(10^{-14} m\). Minimální rotační energie atomu je tedy mnohem větší než \(\frac{1}{2}k_BT\) pro jakoukoli dosažitelnou teplotu a dostupná energie nestačí k tomu, aby se atom otáčel. K tomuto bodu se vrátíme při diskusi o diatomických a polyatomických plynech v další části.
příklad \(\PageIndex{1}\): Výpočet Kinetické Energie a Rychlost Molekuly Plynu
- Jaká je průměrná kinetická energie molekuly plynu na \(20.0^oC\) (pokojová teplota)?
- Najděte efektivní rychlost molekuly dusíku (\(N_2\)) při této teplotě.
Strategie
(a) Je známo, že v rovnici pro průměrná kinetická energie je teplota:
\
Před dosazením hodnot do této rovnice, musíme převést dané teplotě v kelvinech: \(T = (20.0 + 273) \, K = 293 \, K\). Můžeme najít rms rychlost molekuly dusíku pomocí rovnice.
\
ale nejprve musíme najít hmotnost molekuly dusíku. Získání molární hmotnost dusíku \(N_2\) z periodické tabulky, zjistíme,
\
Řešení
- teplota je samo o sobě dostačující pro nás najít průměrnou translační kinetické energie. Dosazením teploty do translační kinetické rovnice energie dává \
- Nahrazení této hmotnosti a hodnoty pro \(k_B\) do rovnice pro \(v_{rms}\) výnosy \
Význam
Všimněte si, že průměrná kinetická energie na molekulu je nezávislý na typu molekuly. Průměrná translační kinetická energie závisí pouze na absolutní teplotě. Kinetická energie je ve srovnání s makroskopickými energiemi velmi malá, takže se necítíme, když molekula vzduchu zasáhne naši pokožku. Na druhé straně, je mnohem větší, než typické rozdíl v gravitační potenciální energie, kdy se molekula pohybuje z horní do spodní místnosti, takže naše zanedbání gravitace je oprávněné v typických reálných situacích. Rms rychlost molekuly dusíku je překvapivě velká. Tyto velké molekulární rychlosti nevedou k makroskopickému pohybu vzduchu, protože molekuly se pohybují ve všech směrech se stejnou pravděpodobností. Střední volná dráha (vzdálenost molekula se pohybuje v průměru mezi srážkami, diskutovat později v této kapitole) molekul ve vzduchu je velmi malý, takže molekuly pohybovat rychle, ale ne moc daleko se v druhé. Vysoká hodnota rms rychlosti se odráží v rychlosti zvuku, která je asi 340 m / s při pokojové teplotě. Čím vyšší je rms rychlost molekul vzduchu, tím rychlejší zvukové vibrace mohou být přenášeny vzduchem. Rychlost zvuku roste s teplotou a je větší u plynů s malou molekulární hmotností, jako je helium (viz Obrázek \(\PageIndex{3}\)).
Například \(\PageIndex{2}\): Výpočet Teploty: Únikové Rychlosti Atomy Helia
uniknout Zemské gravitaci, objekt v horní části atmosféry (ve výšce 100 km) musí cestovat daleko od Země na to, 11.1 km/s. Tato rychlost se nazývá úniková rychlost. Při jaké teplotě by atomy helia měly rms rychlost rovnající se únikové rychlosti?
strategie
Identifikujte známé a neznámé a určete, které rovnice použít k vyřešení problému.
Řešení
- Identifikovat knowns: v je úniková rychlost, 11.1 km/s.
- Identifikovat neznámé: My potřebujeme řešení pro teplotu, T. Musíme také řešení pro hmotnost m atomu helia.
- Určete, které rovnice jsou potřebné.
- pro získání hmotnosti m atomu helia můžeme použít informace z periodické tabulky: \
- K vyřešení pro teplotu T, můžeme uspořádat \ výnos \
- Nahradit známých hodnot do rovnice a řešit pro neznámé, \ a \
Význam
Tato teplota je mnohem vyšší než teplota atmosféry, což je přibližně 250 K (\(-25^oC\) nebo \(-10^z\)) ve vysoké nadmořské výšce. Velmi málo atomy helia jsou ponechány v atmosféře, ale mnozí byli přítomni, když atmosféra byla vytvořena, a další jsou vždy vytvořené radioaktivním rozpadem (viz kapitola o jaderné fyzice). Důvodem ztráty atomů helia je to, že malý počet atomů helia má rychlosti vyšší než úniková rychlost země i při normálních teplotách. Rychlost atomu helia se mění z jedné kolize na druhou, takže v každém okamžiku existuje malá, ale nenulová šance, že rychlost atomu je větší než úniková rychlost. Šance je dostatečně vysoká, že téměř všechny atomy helia, které byly v atmosféře, dosáhly únikové rychlosti ve vysokých nadmořských výškách a unikly gravitačnímu tahu země. Těžší molekuly, jako je kyslík, dusík a voda, mají menší rms rychlosti, a proto je mnohem méně pravděpodobné, že některý z nich bude mít rychlost větší než úniková rychlost. Ve skutečnosti je pravděpodobnost tak malá, že miliardy let jsou nutné ke ztrátě významného množství těžších molekul z atmosféry. Obrázek \(\PageIndex{4}\) ukazuje vliv nedostatku atmosféry na Měsíc. Protože gravitační síla měsíce je mnohem slabší, ztratila téměř celou atmosféru. Atmosféry Země a dalších těles jsou porovnány v této kapitole cvičení.

Cvičení \(\PageIndex{2}\)
Pokud se domníváte, velmi malý předmět, jako zrnko pylu, v plynu, pak počet molekul, stávkující jeho povrchu by také být relativně malé. Očekávali byste, že zrno pylu zažije kolísání tlaku v důsledku statistických výkyvů v počtu molekul plynu, které ho v daném čase zasáhnou?
odpověď
Ano. Takové výkyvy ve skutečnosti nastat, pro tělo jakékoli velikosti v plynu, ale od té doby počty molekul jsou obrovské pro makroskopické těla, výkyvy jsou malé procento počet kolizí, a průměry se mluví v této části se liší nepatrně. Zhruba řečeno, výkyvy jsou nepřímo úměrné druhé odmocnině počtu kolizí, takže u malých těles se mohou stát významnými. To bylo ve skutečnosti pozorováno v devatenáctém století u pylových zrn ve vodě a je známé jako Brownian motion.
tlak par, parciální tlak a Daltonův zákon
tlak, který by plyn vytvořil, kdyby obsadil celkový dostupný objem, se nazývá parciální tlak plynu. Pokud jsou smíchány dva nebo více plynů, dojde k tepelné rovnováze v důsledku kolizí mezi molekulami; proces je analogický s vedením tepla, jak je popsáno v kapitole o teplotě a teplu. Jak jsme viděli z kinetické teorie, když plyny mají stejnou teplotu, jejich molekuly mají stejnou průměrnou kinetickou energii. Každý plyn tedy dodržuje zákon o ideálním plynu samostatně a vyvíjí stejný tlak na stěny nádoby, jaký by byl, kdyby byl sám. Proto je ve směsi plynů celkový tlak součtem parciálních tlaků složkových plynů, za předpokladu ideálního chování plynu a bez chemických reakcí mezi složkami. Tento zákon je známý jako Daltonův zákon parciálních tlaků, po anglickém vědci Johnu Daltonovi (1766-1844), který jej navrhl. Daltonův zákon je v souladu se skutečností, že tlaky se přidávají podle Pascalova principu.
ve směsi ideálních plynů v tepelné rovnováze je počet molekul každého plynu úměrný jeho parciálnímu tlaku. Tento výsledek vyplývá z aplikace zákona ideálního plynu na každý ve tvaru \(p / n = RT / V\). Protože pravá strana je stejná pro jakýkoli plyn při dané teplotě v nádobě o daném objemu, levá strana je stejná.
- parciální tlak je tlak, který by plyn vytvořil, kdyby existoval sám.
- Daltonův zákon říká, že celkový tlak je součtem parciálních tlaků všech přítomných plynů.
- pro jakékoliv dva plyny (označené 1 a 2) v rovnováze v nádobě, \(\frac{p_1}{n_1} = \frac{p_2}{n_2}.\)
důležitou aplikací parciálního tlaku je to, že v chemii funguje jako koncentrace plynu při určování rychlosti reakce. Zde uvádíme pouze to, že parciální tlak kyslíku v plicích člověka je zásadní pro život a zdraví. Dýchání vzduchu, který má parciální tlak kyslíku pod 0.16 atm může zhoršit koordinaci i úsudek, zvláště u lidí, není aklimatizovaný na vysokou nadmořskou výšku. Nižší parciální tlaky \(O_2\) mají vážnější účinky; parciální tlaky pod 0,06 atm mohou být rychle fatální a trvalé poškození je pravděpodobné, i když je osoba zachráněna. Pocit nutnosti dýchat, jako když držíte dech, je však způsoben mnohem více vysokými koncentracemi oxidu uhličitého v krvi než nízkými koncentracemi kyslíku. Tedy, v případě malé místnosti nebo skříně je vyplněn vzduchem s nízkou koncentrací kyslíku, možná proto, netěsný válec některých stlačený plyn je uložen tam, člověk nebude cítit žádné „dusivý“ pocit a mohou jít do křeče nebo ztratit vědomí, aniž by si všiml, nic špatného. Bezpečnostní inženýři věnují tomuto nebezpečí značnou pozornost.
Další důležitá aplikace parciální tlak je tlak nasycených par, což je parciální tlak páry, při které je v rovnováze s kapalinou (nebo pevnou, v případě sublimace) fáze téže látky. Při jakékoliv teplotě, parciální tlak vody ve vzduchu nesmí překročit tlak nasycených par vody při této teplotě, protože vždy, když parciální tlak dosáhne tlaku par, voda kondenzuje ze vzduchu. Rosa je příkladem této kondenzace. Teplota, při které dochází ke kondenzaci vzorku vzduchu, se nazývá rosný bod. Snadno se měří pomalým ochlazováním kovové koule; rosný bod je teplota, při které se na kouli poprvé objeví kondenzace.
tlak par vody při některých teplotách zájem o meteorologii jsou uvedeny v Tabulce\(\PageIndex{1}\).
| T(\(^oC\)) | Tlak nasycených Par (Pa) |
|---|---|
| 0 | 610.5 |
| 3 | 757.9 |
| 5 | 872.3 |
| 8 | 1073 |
| 10 | 1228 |
| 13 | 1497 |
| 15 | 1705 |
| 18 | 2063 |
| 20 | 2338 |
| 23 | 2809 |
| 25 | 3167 |
| 30 | 4243 |
| 35 | 5623 |
| 40 | 7376 |
The relative humidity (R.H.) při teplotě T je definována
\
relativní vlhkosti \(100\%\) znamená, že parciální tlak vody je rovná tlaku par; jinými slovy, vzduch je nasycen vodou.
příklad \(\PageIndex{3}\): výpočet relativní vlhkosti
jaká je relativní vlhkost, když je teplota vzduchu \(25^oC\) a rosný bod je \(15^oC\)?
strategie
jednoduše vyhledáme tlak par při dané teplotě a to v rosném bodě a najdeme poměr.
řešení
\
význam
R.H. je důležité pro naše pohodlí. Hodnota \(53.8\%\) je v rozmezí \(40\%\) až \(60\%\) doporučená pro pohodlí v interiéru.
Jak bylo uvedeno v kapitole o teplota a teplo, teplota málokdy klesne pod rosný bod, protože když to dosáhne rosný bod nebo bod mrazu, voda kondenzuje a uvolňuje poměrně velké množství latentní teplo odpařování.
střední volná cesta a střední volný čas
kolize nyní zvažujeme explicitně. Obvyklý první krok (což je všechny vezmeme) je pro výpočet střední volná dráha, \(\lambda\), průměrná vzdálenost, kterou molekula urazí mezi srážkami s jinými molekulami, a tím volný čas \(\tau\), průměrná doba mezi srážkami molekul. Pokud předpokládáme, že všechny molekuly jsou koule s poloměrem \(r\), molekula se srazí s jinou, pokud jsou jejich centra ve vzdálenosti 2r od sebe. Pro danou částici říkáme, že plocha kružnice s tímto poloměrem, \(4\pi r^2\), je „průřez“ pro kolize. Jak se částice pohybuje, sleduje válec s touto plochou průřezu. Střední volná dráha je délka \(\lambda\) tak, že očekávaný počet dalších molekul ve válci délky \(\lambda\) a průřezu \(4 \ pi r^2\) je 1. Pokud jsme dočasně ignorovat pohybu molekul jiný, než ten, který jsme hledali očekávané číslo je číslo, hustota molekul, N/V, krát objem, a objem je \(4\pi r^2 \lambda\), máme tedy \((N/V)4\pi r^2 \lambda = 1\), nebo
\
pohyb všech molekul v úvahu, je výpočet mnohem těžší, ale jediná změna je faktor \(\sqrt{2}\). Výsledkem je,
\
V ideálním plynu, můžeme dosadit \(V/N = k_BT/p\) získat
\
průměr volný čas \(\tau\) je jednoduše střední volná dráha děleno typická rychlost, a obvyklá volba je rms rychlosti. Pak
\
Výpočet Znamenat Volný Čas
Najít na mysli volný čas pro argonové atomy (\(M = 39.9 \, g/mol\)) na teplotu \(0^oC\) a tlaku 1,00 atm. Vezměte poloměr atomu argonu na \(1,70 \ krát 10^{-10}\mezera m\).
řešení
- Identifikujte knowns a převeďte na jednotky SI. Víme, že molární hmotnost je 0.0399 kg/mol, teplota 273 K, tlak je \(1.01 \times 10^5 \ Pa\) a poloměrem \(1.70 \times 10^{-10} \, m\).
- Najděte rychlost rms: \(v_{rms} = \ sqrt {\frac{3RT}{M}} = 413 \, m / s\).
- Náhrada do rovnice pro střední volného času: \
Význam
těžko můžeme porovnat tento výsledek s naší intuicí o molekuly plynu, ale dává nám obrázek molekuly srážejí s velmi vysokou frekvencí.
cvičení \(\PageIndex{4}\)
který má delší střední volnou cestu, kapalnou vodu nebo vodní páru ve vzduchu?
odpověď
v kapalině jsou molekuly velmi blízko u sebe a neustále se srazí. Aby byl plyn téměř ideální, protože vzduch je za běžných podmínek, musí být molekuly velmi daleko od sebe. Průměrná volná cesta je tedy ve vzduchu mnohem delší.
Přispěvatelé a Pravomocí
-
Samuel J. Ling (Truman State University), Jeff Sanny (Loyola Marymount University), a Bill Moebs s mnoha přispívajících autorů. Tato práce je licencována OpenStax University Physics pod licencí Creative Commons Attribution License (by 4.0).