Molekulové Orbitaly z Allylic Karbokation
stabilitu karbokation z propenu je vzhledem k konjugovaný π-elektronový systém. „Dvojná vazba“ ve skutečnosti neexistuje. Místo toho je to skupina 3 sousedních, překrývajících se, nehybridizovaných P orbitalů, které nazýváme konjugovaný π elektronový systém. Můžete jasně vidět interakce mezi všemi třemi orbitaly p ze tří uhlíků, což vede k opravdu stabilnímu kationtu. Všechno to přijde tam, kde je umístění uhlíku s nedostatkem elektronů.
molekulární orbitální popisy mohou vysvětlit allylickou stabilitu ještě jiným způsobem pomocí 2-propenylu. Obr.6
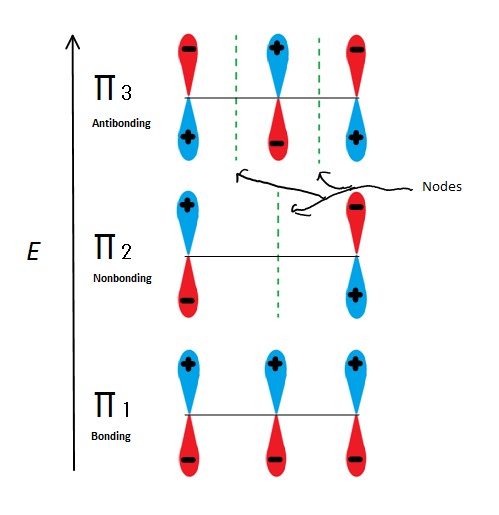
Obr.6 Znázorňuje 3 možné Molekulové orbitaly 2-propenyl
Pokud vezmeme jen π molekulární orbital a ne žádné y, dostaneme tři z nich. π1 je lepení s žádné uzly, π 2 je nonbonding (jinými slovy, stejné energie jako pravidelný p-orbital) s node, a π3 je antibonding s 2 uzly (žádné orbitaly jsou v interakci). První dva elektrony půjdou do molekulárního orbitalu π1, bez ohledu na to, zda se jedná o kation, radikál nebo anion. Pokud se jedná o radikál nebo anion, další elektron jde do molekulárního orbitalu π2. Poslední aniontový elektron jde také do nebondingového orbitalu. Takže bez ohledu na to, jaké centrum uhlíku existuje, žádný elektron nikdy nepůjde do antibonding orbitalu.
vazebné orbitaly jsou nejnižší energetické orbitaly a jsou příznivé, proto jsou vyplněny jako první. I když nonbonding orbitaly mohou být vyplněny, celková energie systému je stále nižší a stabilnější vzhledem k naplněné vazebné molekulové orbitaly.
Tento obrázek také ukazuje, že π 2 je pouze molekulární orbital, kde electrion liší, a to je také místo, kde jeden uzel prochází přes střed. Z tohoto důvodu jsou náboje molekuly hlavně na dvou koncových uhlících a nikoli na Středním uhlíku.
Tento molekulární orbitální popis může také ilustrovat stabilitu allylických uhlíkových Center na obrázku 7.
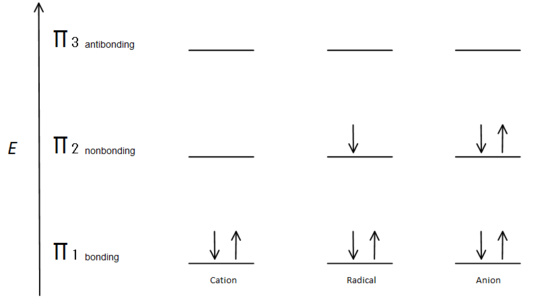
Obr.7 diagram ukazující, jak se elektrony plní na základě principu Aufbau.
π vazebný orbital má nižší energii než nebondingový orbital p. Protože každé zobrazené uhlíkové centrum má dva elektrony v nižší energii, spojující π orbitaly, energie každého systému je celkově snížena (a tím stabilnější), bez ohledu na kation, radikál nebo anion.