Video \(\PageIndex{1}\): lyhyt johdatus Mendelejevin nerouteen.
kun varhaiset kemistit työskentelivät malmien puhdistamiseksi ja löysivät lisää alkuaineita, he tajusivat, että eri alkuaineet voitiin ryhmitellä yhteen niiden samankaltaisen kemiallisen käyttäytymisen perusteella. Yksi tällainen ryhmä sisältää litiumin (Li), natriumin (Na) ja kaliumin (K): Nämä elementit kaikki ovat kiiltäviä, johtavat lämpöä ja sähköä hyvin, ja niillä on samanlaiset kemialliset ominaisuudet. Toiseen ryhmään kuuluvat kalsium (Ca), strontium (Sr) ja barium (Ba), jotka ovat myös kiiltäviä, hyviä lämmön ja sähkön johtimia, ja joilla on yhteisiä kemiallisia ominaisuuksia. Näiden kahden ryhmän erityisominaisuudet eroavat kuitenkin huomattavasti toisistaan. Esimerkiksi: Li, Na ja K ovat paljon reaktiivisempia kuin Ca, Sr ja Ba; Li, Na ja K muodostavat yhdisteitä hapen kanssa kahden atominsa suhteessa yhteen happiatomiin, kun taas Ca, Sr ja Ba muodostavat yhdisteitä, joissa yksi niiden atomeista on yksi happiatomi. Fluorilla (F), kloorilla (Cl), bromilla (Br) ja jodilla (I) on myös samanlaiset ominaisuudet, mutta nämä ominaisuudet poikkeavat huomattavasti edellä mainittujen alkuaineiden ominaisuuksista.
Dimitri Mendelejev Venäjällä (1869) ja Lothar Meyer Saksassa (1870) tunnustivat itsenäisesti, että tuolloin tunnettujen alkuaineiden ominaisuuksien välillä oli ajoittainen suhde. Molemmat julkaistut taulukot, joissa alkuaineet on järjestetty kasvavan atomimassan mukaan. Mendelejev meni kuitenkin askeleen pidemmälle kuin Meyer: hän ennusti pöytänsä avulla sellaisten alkuaineiden olemassaolon, joilla olisi samanlaisia ominaisuuksia kuin alumiinilla ja piillä, mutta joita ei vielä tunneta. Galliumin (1875) ja germaniumin (1886) löydöt tukivat suuresti Mendelejevin työtä. Vaikka mendelejevillä ja Meyerillä oli pitkä kiista prioriteetista, Mendelejevin osuus jaksollisen järjestelmän kehityksessä tunnetaan nykyään laajemmin (Kuva \(\PageIndex{1}\)).
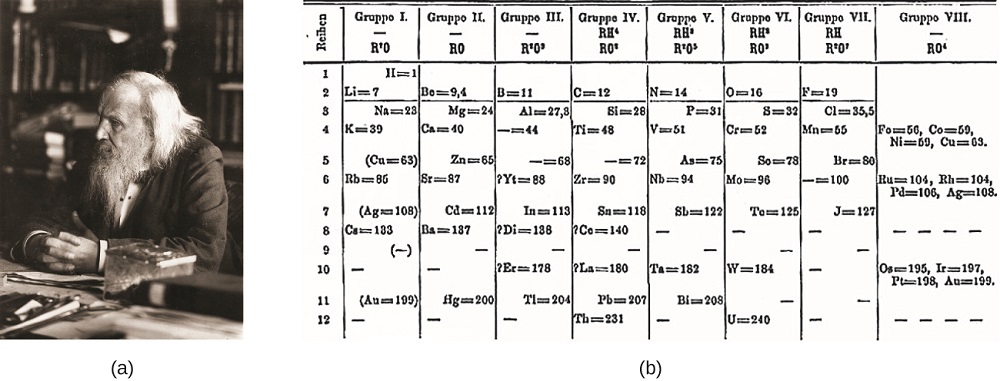
Kuva \(\PageIndex{1}\): a) Dimitri Mendelejevin katsotaan yleisesti luoneen B) alkuaineiden ensimmäisen jaksollisen järjestelmän. (credit a: modification of work by Serge Lachinov; credit b: modification of work by ”Den fjättrade ankan”/Wikimedia Commons)
Video \(\PageIndex{2}\): an introduction to the organization of the periodic table into periods and groups. Tämä organisaatio tulee olemaan tärkeä, kun jatkamme kemian periaatteille rakentamista.
1900-luvulle tultaessa kävi ilmi, että jaksollisessa suhteessa oli kyse atomimassojen sijaan atomiluvuista. Tämän suhteen nykyinen toteamus, jaksollinen laki, on seuraava: alkuaineiden ominaisuudet ovat niiden järjestyslukujen jaksollisia funktioita. Nykyaikainen Jaksollinen järjestelmä järjestää alkuaineet lisääntyvässä järjestyksessä niiden järjestyslukujen mukaan ja ryhmittelee atomeja, joilla on samanlaiset ominaisuudet, samaan pystysarakkeeseen (Kuva \(\PageIndex{2}\)). Jokainen laatikko edustaa alkuainetta ja sisältää sen järjestysluvun, symbolin, keskimääräisen atomimassan ja (joskus) nimen. Elementit on järjestetty seitsemään vaakasuoraan riviin, joita kutsutaan jaksoiksi tai sarjoiksi, ja 18 pystyriviin, joita kutsutaan ryhmiksi. Ryhmät on merkitty jokaisen sarakkeen yläreunaan. Yhdysvalloissa etiketit olivat perinteisesti suuraakkosin merkittyjä numeroita. IUPAC suosittelee kuitenkin käyttämään numeroita 1 – 18, ja nämä merkinnät ovat yleisempiä. Jotta taulukko mahtuisi yhdelle sivulle, taulukon päärungon alapuolelle kirjoitetaan yleensä kahden rivin osat, yhteensä 14 saraketta.

Kuva \(\PageIndex{2}\): jaksollisen järjestelmän alkuaineet on järjestetty niiden ominaisuuksien mukaan.
monet alkuaineet eroavat dramaattisesti kemiallisilta ja fysikaalisilta ominaisuuksiltaan, mutta jotkin alkuaineet ovat samanlaisia käyttäytymiseltään. Esimerkiksi monet elementit näyttävät kiiltäviltä, ovat muokattavia (voivat olla epämuodostuneita rikkomatta) ja sitkeitä (voidaan vetää johtoihin) ja johtavat lämpöä ja sähköä hyvin. Muut alkuaineet eivät ole kiiltäviä, muokattavia tai sitkeitä, ja ne ovat huonoja lämmön ja sähkön johtimia. Voimme lajitella elementit suuriin luokkiin yhteisiä ominaisuuksia: metallit (elementit, jotka ovat kiiltäviä, muokattavaksi, hyvä johtimet lämmön ja sähkön—tummennetut keltainen); nonmetals (elementit, jotka näyttävät tylsä, huono johtimet lämmön ja sähkön-tummennetut vihreä); ja metalloidit (elementtejä, jotka johtavat lämpöä ja sähköä kohtalaisen hyvin, ja niillä on joitakin ominaisuuksia metallien ja joitakin ominaisuuksia nonmetals—tummennetut violetti).
alkuaineet voidaan luokitella myös pääjoukon alkuaineisiin (tai edustaviin alkuaineisiin) sarakkeissa 1, 2 ja 13-18; siirtymämetalleihin sarakkeissa 3-12; ja sisempiin siirtymämetalleihin kahdella rivillä taulukon alareunassa (ylintä riviä kutsutaan lantanideiksi ja alinta riviä aktinideiksi; Kuva \(\PageIndex{3}\)). Alkuaineet voidaan jakaa edelleen tarkempien ominaisuuksien, kuten niiden muodostamien yhdisteiden koostumuksen perusteella. Esimerkiksi ryhmän 1 alkuaineet (ensimmäinen sarake) muodostavat yhdisteitä, jotka koostuvat alkuaineen yhdestä atomista ja yhdestä vetyatomista. Näitä alkuaineita (vetyä lukuun ottamatta) kutsutaan alkalimetalleiksi, ja niillä kaikilla on samanlaiset kemialliset ominaisuudet. Ryhmän 2 alkuaineet (toinen sarake) muodostavat yhdisteitä, jotka koostuvat alkuaineen yhdestä atomista ja kahdesta vetyatomista: näitä kutsutaan emäksisiksi maametalleiksi, joilla on samat ominaisuudet kyseisen ryhmän jäsenten keskuudessa. Muita ryhmiä, joilla on erityiset nimet, ovat pniktogeenit (ryhmä 15), kalkogeenit (ryhmä 16), halogeenit (ryhmä 17) ja jalokaasut (ryhmä 18, tunnetaan myös nimellä inertit kaasut). Ryhmiin voidaan viitata myös ryhmän ensimmäisellä alkuaineella: esimerkiksi kalkogeenejä voidaan kutsua happiryhmäksi tai happiperheeksi. Vety on ainutlaatuinen, epämetallinen alkuaine, jonka ominaisuudet muistuttavat sekä ryhmän 1 että ryhmän 17 alkuaineita. Tästä syystä vety voidaan esittää molempien ryhmien yläosassa tai yksinään.
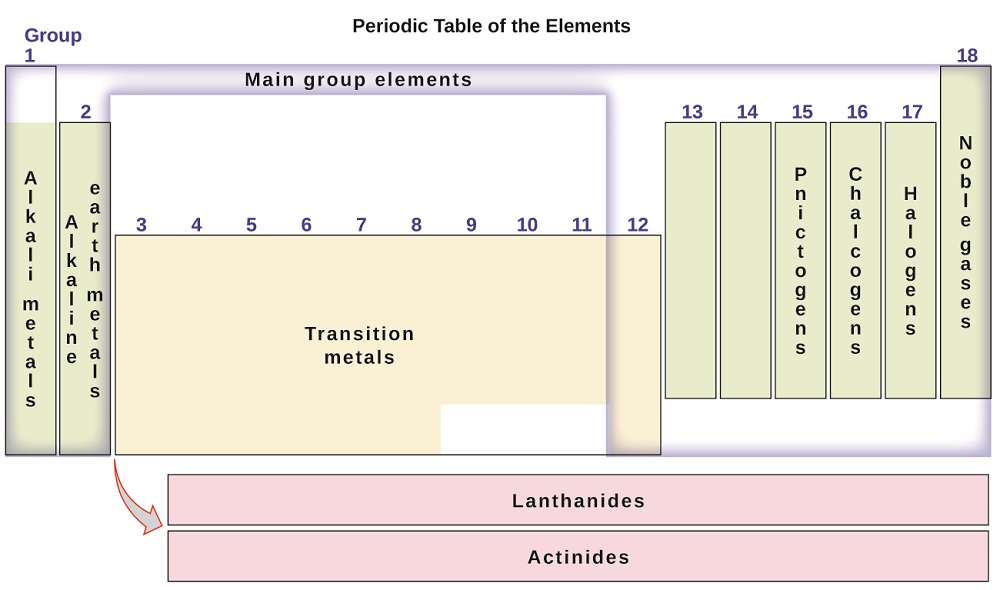
Kuva \(\PageIndex{3}\): Jaksollinen järjestelmä järjestää ominaisuuksiltaan samankaltaiset alkuaineet ryhmiksi.
esimerkki \(\PageIndex{1}\): alkuaineiden ryhmien nimeäminen
jokaisen seuraavan alkuaineen atomit ovat välttämättömiä elämälle. Anna ryhmän nimi seuraaville elementeille:
- chlorine
- calcium
- sodium
- sulfur
Solution
The family names are as follows:
- halogen
- alkaline earth metal
- alkali metal
- chalcogen
Exercise \(\PageIndex{1}\)
Give the group name for each of the following elements:
- krypton
- selenium
- barium
- litium
answer a
jalokaasu
vastaus b
kalkogeeni
vastaus C
alkalimetalli
vastaus D
alkalimetalli
jaksollista järjestelmää tutkiessa saattoi huomata jotain joidenkin alkuaineiden atomimassoista. Alkuaineen 43 (teknetium), alkuaineen 61 (prometium) ja useimpien alkuaineiden, joiden järjestysluku on 84 (polonium) tai korkeampi, atomimassa ilmoitetaan hakasulkeissa. Tämä tehdään alkuaineille, jotka koostuvat kokonaan epästabiileista, radioaktiivisista isotoopeista (radioaktiivisuudesta kerrotaan tarkemmin ydinkemian luvussa). Näille alkuaineille ei voida määrittää keskimääräistä atomipainoa, koska niiden radioisotoopit voivat vaihdella huomattavasti suhteellisesti lähteestä riippuen tai niitä ei välttämättä edes esiinny luonnossa. Hakasulkeissa oleva luku on alkuaineen pysyvimmän isotoopin atomimassaluku (ja likimääräinen atomimassa).
Yhteenveto
Video \(\PageIndex{3}\): Yhteenveto jaksollisen järjestelmän löydöistä ja ominaisuuksista.
alkuaineiden samankaltaisten ominaisuuksien jaksollisen toistumisen havaitseminen johti jaksollisen järjestelmän muodostamiseen, jossa alkuaineet on järjestetty kasvavan järjestysluvun mukaiseen järjestykseen jaksoiksi kutsuttuihin riveihin ja ryhmiksi kutsuttuihin sarakkeisiin. Samaan jaksollisen järjestelmän ryhmään kuuluvilla alkuaineilla on samanlaiset kemialliset ominaisuudet. Alkuaineet voidaan luokitella metalleiksi, metalloideiksi ja epämetalleiksi tai pääryhmään alkuaineiksi, siirtymämetalleiksi ja sisemmiksi siirtymämetalleiksi. Ryhmät on numeroitu 1-18 vasemmalta oikealle. Ryhmän 1 alkuaineita kutsutaan alkalimetalleiksi, ryhmän 2 alkuaineita maametalleiksi, ryhmän 15 alkuaineita pniktogeeneiksi, ryhmän 16 alkuaineita kalkogeeneiksi, ryhmän 17 alkuaineita halogeeneiksi ja ryhmän 18 alkuaineita jalokaasuiksi.